Cameron Merritt
0
4230
743
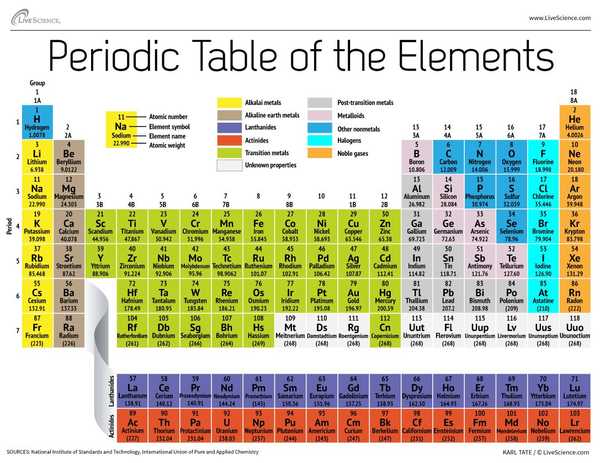
I slutet av 1800-talet publicerade den ryska kemisten Dmitri Mendeleev sitt första försök att gruppera kemiska element enligt deras atomvikter. Det var bara cirka 60 element kända vid den tiden, men Mendeleev insåg att när elementen var organiserade efter vikt, vissa typer av element inträffade i regelbundna intervaller eller perioder.
Idag, 150 år senare, känner kemister officiellt igen 118 element (efter tillägget av fyra nykomlingar 2016) och använder fortfarande Mendeleevs periodiska elementtabell för att organisera dem. Tabellen börjar med den enklaste atomen, väte, och organiserar sedan resten av elementen med atomnummer, vilket är antalet protoner som vardera innehåller. Med en handfull undantag motsvarar elementens ordning den ökande massan för varje atom.
Tabellen har sju rader och 18 kolumner. Varje rad representerar en period; periodnumret för ett element anger hur många av dess energinivåer som innehåller elektroner. Natrium sitter till exempel i den tredje perioden, vilket innebär att en natriumatom vanligtvis har elektroner i de tre första energinivåerna. Att flytta ner i tabellen är perioder längre eftersom det tar fler elektroner för att fylla de större och mer komplexa yttre nivåerna.
Kolumnerna i tabellen representerar grupper eller familjer av element. Elementen i en grupp ser och uppträder ofta på samma sätt, eftersom de har samma antal elektroner i deras yttersta skal - ansiktet de visar för världen. Grupp 18-element på längst till höger om bordet har till exempel helt fulla yttre skal och deltar sällan i kemiska reaktioner.
Element klassificeras vanligtvis antingen av metall eller som icke-metall, men skiljelinjen mellan de två är oklar. Metallelement är vanligtvis goda ledare för el och värme. Undergrupperna inom metallerna är baserade på liknande egenskaper och kemiska egenskaper hos dessa samlingar. Vår beskrivning av den periodiska tabellen använder vanligt accepterade grupperingar av element enligt Los Alamos National Laboratory.
Alkaliska metaller: Alkalimetallerna utgör det mesta av grupp 1, tabellens första kolumn. Glänsande och mjuka nog att klippa med en kniv, dessa metaller börjar med litium (Li) och slutar med francium (Fr). De är också extremt reaktiva och kommer att spridas i låga eller till och med explodera vid kontakt med vatten, så kemister lagrar dem i oljor eller inerta gaser. Väte, med sin enda elektron, lever också i grupp 1, men gasen anses vara en icke-metallisk.
Alkaliska jordartsmetaller: Jordalkalimetallerna utgör grupp 2 i det periodiska systemet, från beryllium (Be) till radium (Ra). Var och en av dessa element har två elektroner i sin yttersta energinivå, vilket gör att de alkaliska jordarna är reaktiva nog att de sällan finns ensamma i naturen. Men de är inte lika reaktiva som alkalimetallerna. Deras kemiska reaktioner förekommer vanligtvis långsammare och producerar mindre värme jämfört med alkalimetallerna.
lantanider: Den tredje gruppen är mycket för lång för att passa in i den tredje kolumnen, så den bryts ut och vänds åt sidan för att bli den övre raden på ön som flyter längst ner i bordet. Detta är lantaniderna, element 57 till 71 - lantan (La) till lutetium (Lu). Elementen i denna grupp har en silvrig vit färg och täcker vid kontakt med luft.
aktinider: Aktinidema rader öns nedre rad och innefattar element 89, actinium (Ac), till 103, lawrencium (Lr). Av dessa element förekommer endast thorium (Th) och uran (U) naturligt på jorden i betydande mängder. Alla är radioaktiva. Aktiniderna och lanthaniderna bildar tillsammans en grupp som kallas de inre övergångsmetallerna.
Övergångsmetaller: Återgå till tabellens huvuddel representerar resten av grupperna 3 till 12 resten av övergångsmetallerna. Hårda men formbara, glänsande och med god konduktivitet, dessa element är vad du vanligtvis tänker på när du hör ordet metal. Här bor många av metallvärldens största hits - inklusive guld, silver, järn och platina.
Metaller efter övergång: Inför hoppet till den icke-metala världen är delade egenskaper inte snyggt uppdelade längs vertikala grupplinjer. Metallerna efter övergången är aluminium (Al), gallium (Ga), indium (In), talium (Tl), tenn (Sn), bly (Pb) och vismut (Bi), och de sträcker sig över grupp 13 till grupp 17. Dessa element har några av de klassiska egenskaperna för övergångsmetallerna, men de tenderar att vara mjukare och uppträder sämre än andra övergångsmetaller. Många periodiska tabeller har en fet "trappsteg" -linje under den diagonala förbindande boren med astatin. Metallerna efter övergången kluster till vänster om denna linje.
metalloider: Metalloiderna är bor (B), kisel (Si), germanium (Ge), arsenik (As), antimon (Sb), tellurium (Te) och polonium (Po). De utgör trappan som representerar den gradvisa övergången från metaller till icke-metaller. Dessa element uppträder ibland som halvledare (B, Si, Ge) snarare än som ledare. Metalloider kallas också "semimetaler" eller "dåliga metaller."
icke-metaller: Allt annat längst upp till höger på trappan - plus väte (H), strandat långt tillbaka i grupp 1 - är en icke-metallisk. Dessa inkluderar kol (C), kväve (N), fosfor (P), syre (O), svavel (S) och selen (Se).
halogener: De fyra bästa elementen i grupp 17, från fluor (F) till astatin (At), representerar en av två delmängder av icke-metallerna. Halogenerna är ganska kemiskt reaktiva och tenderar att para ihop sig med alkalimetaller för att producera olika typer av salt. Bordsaltet i ditt kök är till exempel ett äktenskap mellan alkalimetallnatrium och halogenklor.
Ädelgaser: Färglösa, luktfria och nästan helt icke-reaktiva, de inerta eller ädla gaserna rundar bordet i grupp 18. Många kemister förväntar sig att Oganesson, ett av de fyra nyligen nämnda elementen, delar dessa egenskaper; emellertid, eftersom detta element har en halveringstid i millisekunderna, har ingen kunnat testa det direkt. Oganesson slutför den sjunde perioden i det periodiska systemet, så om någon lyckas syntetisera element 119 (och loppet för att göra det redan är igång) kommer det att slinga runt för att starta rad åtta i alkalimetallkolonnen.
På grund av den cykliska naturen som skapas av periodiciteten som ger tabellen sitt namn föredrar vissa kemister att visualisera Mendeleevs tabell som en cirkel.
Ytterligare Resurser:
- Se denna korta video om periodiska tabeller och elementgrupper från Crash Course.
- Bläddra igenom denna interaktiva periodiska tabell över element.
- Kolla in denna gratis, utbildningsresurs för att förstå elementära grupper från CK-12.















